未承認薬・適応外薬を使った臨床試験について
- TOP
- 一般の皆さん・患者さん
- 臨床試験について
- 未承認薬・適応外薬を使った臨床試験について
未承認薬・適応外薬を使った臨床試験について
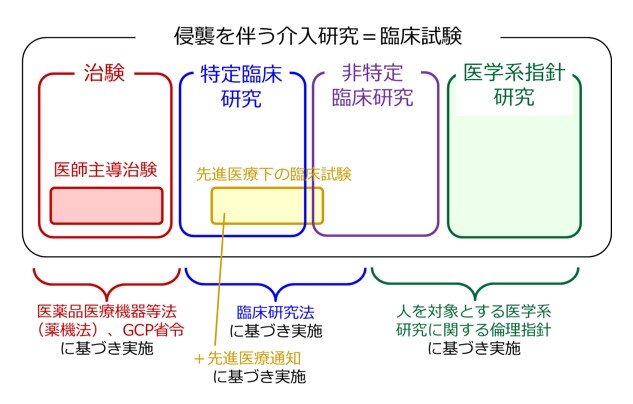
海外で承認されているけれども、日本ではまだ厚生労働省から承認されていない薬(国内未承認薬)を用いて、厚生労働省の承認を得ることを目的として臨床試験を行うためには、通常は医薬品医療機器等法という法律に従った「治験」(あるいは、「医師主導治験」)を実施する必要があります。
また、日本国内で何らかの疾患に対して厚生労働省から承認されている薬を用いた試験であっても、通常の保険診療の中では実施出来ない使い方の薬(適応外薬)を用いて、厚生労働省の承認を得ることを目的として臨床試験を行う場合も、通常は医薬品医療機器等法という法律に従った「治験」(あるいは「医師主導治験」)を実施する必要があります。
ただし治験以外の臨床試験でも、臨床研究法、先進医療制度、患者申出療養制度などを利用して未承認薬や適応外薬を用いた臨床試験を行えるケースもあります。

なお、海外で承認されているけれどもまだ日本で承認されていない薬のうち、一部の薬については、厚生労働省のウェブサイト「 医療上の必要性の高い未承認薬・適応外薬使用問題検討会議での検討結果を受けて開発企業の募集または開発要請を行った医薬品のリスト」から情報を入手することが出来ます。
また、現在開発中の薬や、既に国内で承認されている薬で新たな効能・効果の追加を目指している薬について、厚生労働省の「Japan Registry of Clinical Trials(jRCT)」財団法人日本医薬情報センター(JAPIC)の「臨床試験情報」、独立行政法人 医薬品医療機器総合機構の「人道的見地から実施される治験(拡大治験)情報」から情報を得ることが出来ます。
さらに、先進医療制度については、厚生労働省の「 先進医療の概要について」から、患者申出療養制度については、厚生労働省の「 患者申出療養制度」から情報を得ることができます。
※これらの情報は、臨床試験に参加する患者さんを募集するための情報ではありませんのでご注意ください。また、JCOGではご紹介しているウェブサイトの内容についてのお問い合わせ等はお受けすることが出来ませんのでご了承ください。
医療上の必要性の高い未承認薬・適応外薬検討会議
医療上の必要性の高い未承認薬・適応外薬検討会議とは、「欧米では使用が認められているが、国内では承認されていない医薬品や適応(以下「未承認薬・適応外薬」という。)について、医療上の必要性を評価すると共に、公知申請への該当性や承認申請のために追加で実施が必要な試験の妥当性を確認すること等により、製薬企業による未承認薬・適応外薬の開発促進に資すること」(医療上の必要性の高い未承認薬・適応外薬検討会議資料)を目的として厚生労働大臣が設置する、学識経験者による会議です。
この会議で取り上げられた医薬品は、製薬企業による承認申請が行われた後、独立行政法人 医薬品医療機器総合機構による審査、薬事・食品衛生審議会への諮問を経て医薬品医療機器等法上の承認に至ります。つまり、医療上の必要性の高い未承認薬・適応外薬検討会議での評価によって医薬品が承認されるわけではなく、その後に実施された治験の結果も含めて「総合機構の審査は厳正中立に」行われます(第4回未承認薬使用問題検討会議速記録)。
医療上の必要性の高い未承認薬・適応外薬検討会議で取り上げられる欧米で承認された医薬品は、必ずしも生存期間を延長することが証明されているとは限りません。また、欧米で承認されているからといって重篤な副作用が無いわけではなく、致死的な副作用・有害事象が発現することもあります。
独立行政法人 医薬品医療機器総合機構による審査の結果は、「医薬品医療機器情報提供ホームページ 新薬の承認に関する情報」で承認後速やかに提供されます。
