「臨床研究法」の対象となる試験の手順
- TOP
- 研究者・医療関係者の皆さん向け
- 手引き
- 研究者
- 「臨床研究法」の対象となる試験の手順
「臨床研究法」の対象となる試験の手順
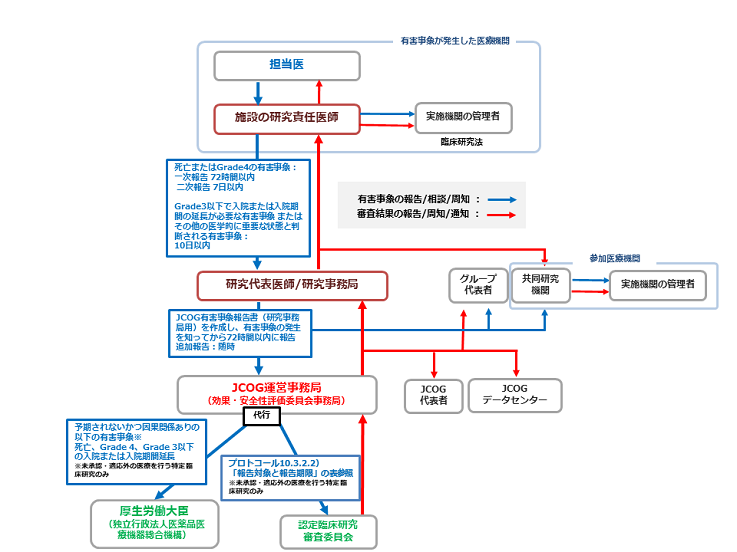
報告ルートと結果通知ルート
緊急報告の対象と報告期限
◆緊急報告の対象となる有害事象
【未承認・適応外の医薬品等を含む特定臨床研究の場合】
1)死亡
- 登録後、プロトコール治療開始前に発生したすべての死亡
- プロトコール治療中または最終治療日から30日以内のすべての死亡(プロトコール治療との因果関係の有無は問わない)
- 最終治療日から31日以降の死亡で、プロトコール治療との因果関係が否定できないもの(definite、probable、possible)
2)死亡につながるおそれのある疾病等
- プロトコール治療中または最終治療日から30日以内に発生したGrade 4の有害事象
- 最終治療日から31日以降に発生したGrade 3/2/1の有害事象かつ有害事象の治療のために24時間以上の入院または入院期間の延長※が必要となるもので、プロトコール治療との因果関係が否定できないもの(definite、probable、possible)
3)治療のために医療機関への入院または入院期間の延長※1が必要とされる疾病等のうち予期されないもの※2
※1「入院または入院期間の延長」については、有害事象の治療のために24時間以上の入院/入院期間の延長が医学的に必要となるもののみを指し、次のような場合は報告対象外とする。
・有害事象が消失または軽快しているものの経過観察のために行われた入院/入院期間の延長
・遠隔地から受診する場合等、患者の負担を軽減する目的の入院/入院期間の延長
・その他、医学的には必要のない入院/入院期間の延長
※2「予期されない」とは「7.予期される有害事象」に記載されていないものを指す
4)障害、5)障害につながるおそれのある疾病等のうち予期されないもの
永続的または顕著な障害・機能不全に陥るもの(骨髄異形成症候群(MDS:Myelodysplastic syndrome)、二次がん等を除く)、あるいは、そのおそれのあるもの
6)1)から5)に準じて重篤である疾病等のうち予期されないもの
7)後世代における先天性の疾患または異常のうち予期されないもの
※「予期されない」とは、「7.予期される有害事象」に記載されていないものを指す
研究代表者/研究事務局は、有害事象の発生を知ってから以下の期間内に、JCOG効果・安全性委員会事務局に該当書類を提出し、JCOG運営事務局を通じて認定臨床研究審査委員会に報告する。
◆緊急報告の対象と報告期限(未承認・適応外の医薬品等を含む特定臨床研究の表)
| 因果関係 | Grade 1-3、入院あり その他医学的に重要な状態 |
Grade 4 | 死亡 | |||
| 予期される | 予期されない | 予期される | 予期されない | 予期される | 予期されない | |
| あり | 【発生施設の対応】 施設研究責任者から研究代表者/研究事務局への報告期限は以下の通り。 |
|||||
| 報告不要 | 初回: 10日以内 追加:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
|
| ⇩ 研究代表者/研究事務局に報告 | ||||||
| 【研究代表者/研究事務局の対応】 有害事象の発生を知ってから以下の期間内に、JCOG運営事務局を通じて 認定臨床研究審査委員会(CRB)/厚生労働大臣に報告する。 |
||||||
| JCOG効果・安全性評価委員会事務局:72時間以内 | ||||||
| ⇩ 事務局にて確認後、CRB/厚生労働大臣への提出を代行 | ||||||
| CRB:15日以内 厚生労働大臣:15日以内 |
CRB:15日以内 | CRB:7日以内 厚生労働大臣:7日以内 |
CRB:15日以内 | CRB:7日以内 厚生労働大臣:7日以内 |
||
| 【提出書類】 | ||||||
| JCOG有害事象報告書 統一様式8 詳細記載用書式 別紙様式2-1 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 別紙様式2-1 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 別紙様式2-1 |
||
| なし | <治療中または最終プロトコール治療日から30日以内のみ> | |||||
| 【発生施設の対応】 施設研究責任者から以下の期間内に、研究代表者/研究事務局に報告する |
||||||
| 報告不要 | 初回:10日以内 追加:随時 |
一次報告:72時間以内 二次報告:7日以内 追加報告:随時 |
||||
| 【研究代表者/研究事務局の対応】 有害事象の発生を知ってから以下の期間内に JCOG効果・安全性評価委員会事務局に報告する |
||||||
| JCOG効果・安全性評価委員会事務局:72時間以内 | ||||||
| 【提出書類】 | ||||||
| JCOG有害事象報告書 | ||||||
※ 「予期されない」とは、「7.予期される有害事象」に記載されていないものを指す
※ 報告を要するものはすべて、研究機関の長に対する報告も必要である。さらに、報告対象のうち予期されない、かつ、因果関係が否定できない場合は、厚生労働大臣に対する報告も必要である。
【未承認・適応外の医薬品等を含まない特定臨床研究、努力義務研究の場合】
1)死亡
- 登録後、プロトコール治療開始前に発生したすべての死亡
- プロトコール治療中または最終治療日から30日以内のすべての死亡(プロトコール治療との因果関係の有無は問わない)
- 最終治療日から31日以降の死亡で、プロトコール治療との因果関係が否定できないもの(definite、probable、possible)
2)死亡につながるおそれのある疾病等
- プロトコール治療中または最終治療日から30日以内に発生したGrade 4の有害事象
- 最終治療日から31日以降に発生したGrade 4の有害事象(表10.1.の事象を除く)で、プロトコール治療との因果関係が否定できないもの(definite、probable、possible)
3)治療のために医療機関への入院または入院期間の延長※1が必要とされる疾病等のうち予期されないもの※2
- プロトコール治療中または最終治療日から30日以内に発生したGrade 3/2/1の有害事象かつ有害事象の治療のために24時間以上の入院または入院期間の延長※が必要となるもの
- 最終治療日から31日以降に発生したGrade 3/2/1の有害事象かつ有害事象の治療のために24時間以上の入院または入院期間の延長※が必要となるもので、プロトコール治療との因果関係が否定できないもの(definite、probable、possible)
※1「入院または入院期間の延長」については、有害事象の治療のために24時間以上の入院/入院期間の延長が医学的に必要となるもののみを指し、次のような場合は報告対象外とする。
・有害事象が消失または軽快しているものの経過観察のために行われた入院/入院期間の延長
・遠隔地から受診する場合等、患者の負担を軽減する目的の入院/入院期間の延長
・その他、医学的には必要のない入院/入院期間の延長
※2「予期されない」とは「7.予期される有害事象」に記載されていないものを指す
4)障害、5)障害につながるおそれのある疾病等のうち予期されないもの
永続的または顕著な障害・機能不全に陥るもの(骨髄異形成症候群(MDS:Myelodysplastic syndrome)、二次がん等を除く)、あるいは、そのおそれのあるもの
6)1)から5)に準じて重篤である疾病等のうち予期されないもの
7)後世代における先天性の疾患または異常のうち予期されないもの
※「予期されない」とは、「7.予期される有害事象」に記載されていないものを指す
研究代表者/研究事務局は、有害事象の発生を知ってから以下の期間内に、JCOG効果・安全性委員会事務局に該当書類を提出し、JCOG運営事務局を通じて認定臨床研究審査委員会に報告する。
◆緊急報告の対象と報告期限(未承認・適応外の医薬品等を含まない特定臨床研究、努力義務研究の表)
| 因果関係 | Grade 1-3、入院あり その他医学的に重要な状態 |
Grade 4 | 死亡 | |||
| 予期される | 予期されない | 予期される | 予期されない | 予期される | 予期されない | |
| あり | 【発生施設の対応】 施設研究責任者から研究代表者/研究事務局への報告期限は以下の通り。 |
|||||
| 報告不要 | 初回: 10日以内 追加:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
一次報告: 72時間以内 二次報告: 7日以内 追加報告:随時 |
|
| ⇩ 研究代表者/研究事務局に報告 | ||||||
| 【研究代表者/研究事務局の対応】 有害事象の発生を知ってから以下の期間内に、JCOG運営事務局を通じて 認定臨床研究審査委員会(CRB)/厚生労働大臣に報告する。 |
||||||
| JCOG効果・安全性評価委員会事務局:72時間以内 | ||||||
| ⇩ 事務局にて確認後、CRB/厚生労働大臣への提出を代行 | ||||||
| CRB:15日以内 | 効安事務局への 報告のみ必要 |
CRB:15日以内 | CRB:15日以内 | CRB:15日以内 | ||
| 【提出書類】 | ||||||
| JCOG有害事象報告書 統一様式8 詳細記載用書式 |
JCOG有害事象報告書 | JCOG有害事象報告書 統一様式8 詳細記載用書式 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 |
JCOG有害事象報告書 統一様式8 詳細記載用書式 |
||
| なし | <治療中または最終プロトコール治療日から30日以内のみ> | |||||
| 【発生施設の対応】 施設研究責任者から以下の期間内に、研究代表者/研究事務局に報告する |
||||||
| 報告不要 | 初回:10日以内 追加:随時 |
一次報告:72時間以内 二次報告:7日以内 追加報告:随時 |
||||
| 【研究代表者/研究事務局の対応】 有害事象の発生を知ってから以下の期間内に JCOG効果・安全性評価委員会事務局に報告する |
||||||
| JCOG効果・安全性評価委員会事務局:72時間以内 | ||||||
| 【提出書類】 | ||||||
| JCOG有害事象報告書 | ||||||
※ 報告を要するものはすべて、研究機関の長に対する報告も必要である。
報告書の記入方法
◆報告書の記載方法
記載の手引きを参考に報告書を作成してください。
認定臨床研究審査委員会への報告が必要な有害事象に該当する際は、医薬品を用いる研究の場合は統一様式8、医療機器を用いる研究の場合は統一様式9および統一様式8.9共通_詳細記載用書式を作成し、JCOG有害事象報告書の別添としてご提出ください。
認定臨床研究審査委員会への報告が不要と判断される場合は、統一様式の提出は不要です。
ダウンロード書式
◇医薬品を使用する試験
◇医療機器を使用する試験
◆厚生労働大臣への報告に用いる追加書式【特定臨床研究のみ】
◇医薬品を使用する試験
◇医療機器を使用する試験
この項目に関するFAQはこちら
