研究代表者/研究事務局の手引き
- TOP
- 研究者・医療関係者の皆さん向け
- 手引き
- 研究代表者/研究事務局
- 研究代表者/研究事務局の手引き
研究代表者/研究事務局の手引き
カプセルサマリー/コンセプト/プロトコール作成~承認編
詳細はポリシー「15 プロトコールの作成と審査」を参照ください
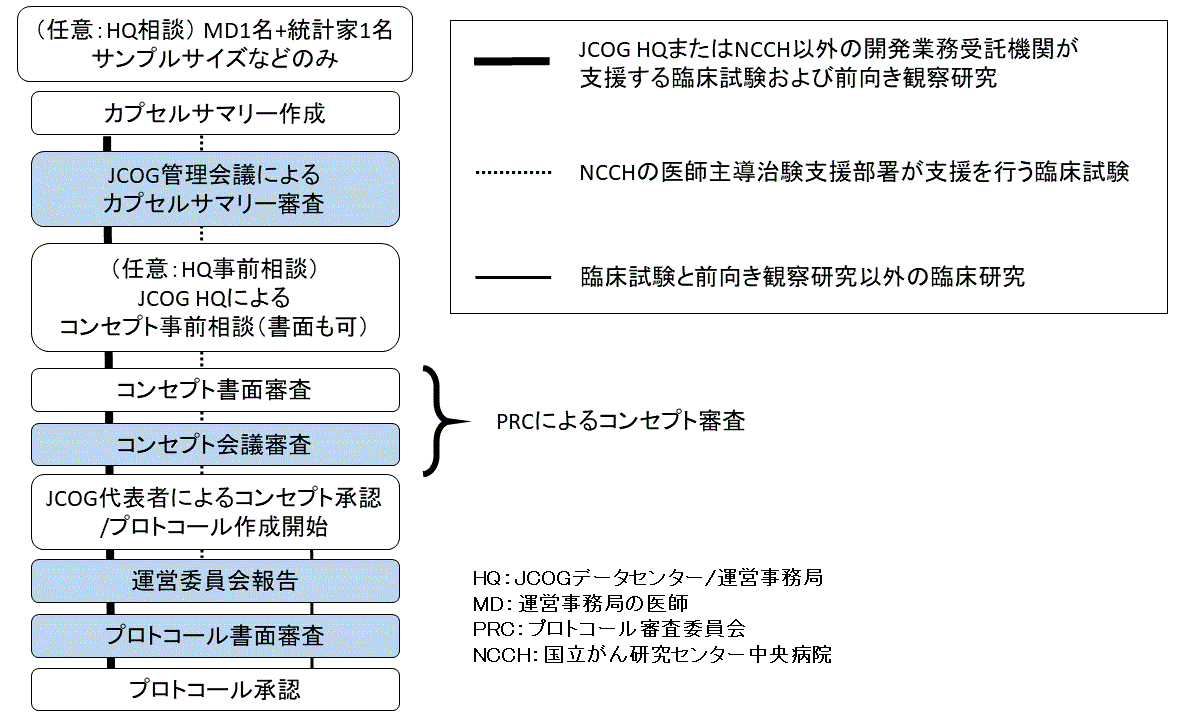
1. カプセルサマリー作成
カプセルサマリーの作成については、「カプセルサマリー」をご参照ください。
2. カプセルサマリー審査の依頼
- カプセルサマリー審査の依頼に先立ち、研究代表者・研究事務局とは別の施設の当該グループのプロトコール審査委員会(PRC)の委員または医学審査員、またはグループ代表委員による当該カプセルサマリーの事前レビュー※が必須です。
- カプセルサマリー提出について、グループ代表者の承認を得てください。審査資料(カプセルサマリーのWordファイル、グループの治療開発マップ)を、レビュー担当の委員を通じて、審査資料の提出締切日までにプロトコール審査委員会事務局(PRC事務局)へメールでご提出ください。
- 審査資料の「提出締切日」は、JCOG管理会議開催日の1週間前(火曜日に開催予定の場合は前週の火曜日まで)です。「JCOG管理会議、プロトコールコンセプト検討会予定表」に明記している「提出締切日」をご確認ください。
- カプセルサマリー審査依頼時は、研究代表者、研究事務局の要件を満たしていなくても審査依頼が可能です。ただし、プロトコール審査委員会事務局(PRC事務局)へのコンセプト提出時までには、研究代表者、研究事務局の要件を満たすことが必須となりますので、「JCOGポリシー10研究代表者/研究事務局」の要件をご確認ください。
3. JCOG管理会議
- JCOG管理会議には、グループを代表する立場で発言できる方が web 参加で 1 人のみ出席可能です。別途、担当者よりご案内いたします。
- 複数案件が提出された場合、1 回の管理会議で 1 件のみ承認となります。
- JCOG管理会議の検討結果は、研究代表者、研究事務局、グループ代表者、グループ事務局に文書で通知いたします。
- JCOG管理会議によるカプセルサマリー承認の有効期間は6か月間です。
カプセルサマリー承認後6か月以内にコンセプトをPRC事務局に提出できない場合は、再度JCOG管理会議での審査・承認が必要となります。
※ 管理会議承認後6か月以内にコンセプトを提出できない場合、以下のどちらかをグループ側で選択する
(2018年11月5日管理会議決定事項より)
1) 当該研究を取り下げる
2) 当該研究のコンセプト提出期限を延長する
2)の場合、再度カプセルサマリーと遅延理由/変更箇所説明書を提出する必要があり、当該カプセルサマリーを基にしたコンセプトが提出されるまでは同グループから新規カプセルサマリーを管理会議に提出できない。
4. コンセプト事前相談
- コンセプトの作成については、「コンセプトマニュアル」をご参照ください。
- コンセプト提出前のデータセンタースタッフによる事前相談を希望する場合は、JCOGデータセンターまでご連絡ください。
- 会議形式、または書面にてコンセプトの事前相談をさせていただきます。詳細は、「コンセプト事前相談」をご覧ください。
5. コンセプト審査の依頼
- コンセプト審査の依頼に先立ち、研究代表者・研究事務局とは別の施設の当該グループのPRCの委員または医学審査員、またはグループ代表委員による当該コンセプトの事前レビュー※が必須です。
- レビュー担当の委員は「コンセプト事前チェックリスト」を用いて、レビューを行ってください。
- コンセプト提出について、グループ代表者の承認を得てください。審査資料(コンセプトのWordファイル、コンセプト事前チェックリスト、グループの治療開発マップ)を、レビュー担当の委員を通じて、審査資料の提出締切日までにプロトコール審査委員会事務局(PRC事務局)へメールでご提出ください。
- 審査資料の「提出締切日」は、コンセプト検討会開催候補日の原則4週間前ですが、開催日によって変わりますので「JCOG管理会議、プロトコールコンセプト検討会予定表」に明記している「提出締切日」をご確認ください。
- コンセプト提出時までに、研究代表者、研究事務局の要件を満たすことが必須となりますので、「JCOGポリシー10研究代表者/研究事務局」の要件をご確認ください。
- 当該グループ(JCOG内共同研究では、主たる研究グループのみ)で、コンセプト承認後1年以上経過している作成中のプロトコールがある場合は、新規コンセプトをご提出いただくことはできません。
(この規定はカプセルサマリー審査依頼時には適用されません)
6. コンセプト検討会
- コンセプト検討会には、原則として研究代表者、および研究事務局のご出席は必須とさせていただきます。グループ代表者、グループ事務局、グループ内レビューを担当したPRC委員・PRC医学審査員・グループ代表委員はご出席が望ましいですが、必須ではありません。JCOG内共同研究の場合は、leading group以外の研究グループより研究代表者、研究事務局、グループ代表者、グループ事務局のいずれか1名以上の参加を必須とします。
- 会議室で開催の場合、研究代表者・事務局、グループ代表者・グループ事務局、事前レビューを担当したグループ代表委員(1名のみ)、PRC委員・PRC医学審査員、放射線治療研究事務局は、旅費支給対象となります
- オブザーバー参加について
- コンセプト検討会オブザーバー参加規定
- 研究グループからオブザーバー参加される場合
コンセプトが検討されるグループ(当該研究グループ)のグループ代表者に参加の承認を得ていただき、グループ事務局 でおとりまとめの上、検討会予定日の参加申込期限日(案内メールに記載有)までに指定のウェブフォームのURLよりお申し込み下さい。 - 当該研究グループ以外の研究グループからオブザーバー参加される場合
所属されている研究グループのグループ代表者に参加の承認を得ていただき、グループ事務局でおとりまとめの上、検討会予定日の参加申込期限日(案内メールに記載有)までに指定のウェブフォームのURLよりお申し込み下さい。 - 一般オブザーバーとして参加される場合
上記に該当しない一般オブザーバー参加を希望される場合は、グループ代表者またはグループ事務局、もしくはJCOGデータセンター/運営事務局の担当者を通じて、検討会の参加申込期限日までに指定のウェブフォームのURLよりお申し込み下さい。
なお、都合上お断りさせていただくこともありますことをご了承ください。
- コンセプト検討会オブザーバー参加規定
7. コンセプト承認
- コンセプト承認後、研究代表者、研究事務局をJCOG研究者のデータベース、および当該グループメーリングリスト、JCOG試験責任者メーリングリストに登録させていただきます。研究者として未登録の場合は、所属施設の施設研究責任者、もしくは施設コーディネーターよりJCOGデータセンターへ担当医登録の手続きをお願いします。
8. プロトコール作成
- プロトコール作成については、JCOG運営事務局 サイエンス部門の担当者とご相談ください。
- 作成にあたっては、「プロトコールマニュアル」をご参照ください。
9. 運営委員会
- 運営委員会では、原則として研究代表者もしくは研究事務局のいずれかにコンセプトの内容をプレゼンテーションしていただきます。当該コンセプトの研究代表者および研究事務局の旅費は支給されます。
- 今後、コンセプトを提出される予定の研究者は、運営委員会にオブザーバー参加することが可能です。参加を希望される場合には、グループ代表者の了承を得た上で、グループ事務局でとりまとめの上、運営委員会の2週間前までに「運営委員会オブザーバー参加申込書 」を用いて、運営事務局までお申し込み下さい。
10. プロトコール審査の依頼
- JCOGデータセンター/運営事務局の担当者を通じて、プロトコールの電子媒体をプロトコール審査委員会事務局へご提出下さい
11.プロトコール審査~承認
- プロトコール審査では、審査意見に対する回答作成や指摘された事項の修正にご対応ください。プロトコールの承認が得られた際には、承認日を記載した正式版プロトコールをJCOGデータセンター/運営事務局の担当者よりお送りします。
- 審査の流れ
- PRC事務局がPRC委員・医学審査員に審査を依頼します。審査期間は通常2週間です。
- 個々の審査委員からレビュー結果が提出されます。個々のレビュー結果は研究代表者・研究事務局にメールで通知されます
- レビューに対する回答案を準備して頂き、データセンター/運営事務局の担当者と回答書の作成を進めてください。回答書のテンプレートはデータセンター/運営事務局の担当者よりお送りします。
- 全レビューアーの審査終了後、primary reviewerから審査結果のまとめが提出されます。提出までの期間は審査終了後、1週間以内です。
- 再審査の要否や、回答不要のレビューコメントが提示されます
- データセンター/運営事務局の担当者と作成した回答書が完成させてください。回答書完成後、担当者からPRCに再度提出します。
- Primary reviewerの審査結果のまとめにより、二次審査、あるいは承認前の最終確認かが変わります
- PRC事務局がPRC委員・医学審査員に審査を依頼します。審査期間は通常2週間です。
試験開始準備編
1. プロトコールの施設への配布と研究実施許可申請の依頼
- JCOG運営事務局からの案内に従い、参加施設へプロトコール一式(プロトコール本体・説明同意文書など)および倫理審査結果通知書等の書類について配布をお願いします。配布する資料は試験毎に異なりますので、ご留意ください。
- 各施設において研究実施許可の依頼をお願いします。
- 当該試験の研究実施許可が得られた施設は、「登録開始手続き完了のお知らせ」メール、もしくは登録状況確認システムにてご確認ください。また、月初めに配信される「登録数月次レポート 」にも掲載しています。
2. 臨床試験登録
- 臨床試験を開始するためには、jRCT(臨床研究等提出・公開システム:https://jrct.niph.go.jp)への試験登録が必要です。
- 登録用原稿の作成については、サイエンス部門のプロトコールコーディネーターとご相談ください。
- jRCTへの登録はJCOG運営事務局にて行います。
3. 試験開始日(登録開始日)
- jRCT登録後、試験情報がjRCT上に公表された日を「試験開始日」と定義し、この日より患者登録の受付を開始します。
- 試験開始日は、JCOG運営事務局よりグループメーリングリストを通じてご案内させていただきます。
試験開始~中止/終了編
1. 登録状況の確認
- JCOG Web Entry Systemへ患者登録がありましたら、登録通知メールがシステムより自動配信されます。登録通知メールは各試験の研究代表者の先生、研究事務局の先生と登録された施設の研究者にも配信されます。
- 試験開始後、登録数クロス集計表にて、以下の事項を閲覧することができます。
- 試験ごとの施設別月別患者登録数(最新の登録状況が即時に確認できます)
- グループ参加施設の試験への登録可能状況とIRB承認書のデータセンター受領状況
※登録数クロス集計表はJCOG Web Entry System(https://secure.jcog.jp/dc/)へログインし、【各種帳票】の「登録数クロス集計表ダウンロード画面」からグループ名と試験番号を選択すると、エクセルファイルがダウンロードできます。
- 月初めに前月分までの登録状況を集計した「登録数月次レポート」を掲載しています。試験をまたいだグループ全体の活動状況や、バイオバンク試料登録状況を把握することができます。試験の進捗と、研究グループの活動状況の確認にご活用ください。
2. プロトコール改訂
- プロトコール改訂をご検討の際は、JCOG運営事務局 サイエンス部門のプロトコールコーディネーターとご相談ください。
- プロトコール改訂審査申請の詳細は、「プロトコール改訂申請手順」をご覧ください。プロトコールの変更は、効果・安全性評価委員会により「改訂」か「改正」かが決定されます。
- プロトコール改訂審査では、審査意見に対する回答作成や指摘された事項の修正にご対応ください。プロトコール改訂が承認された際には、承認日と発効日を記載した正式版改訂プロトコールをJCOG運営事務局のプロトコールコーディネーターが作成します。
- 【臨床研究法】に従う試験(CRBを利用)もしくは【人を対象とする生命科学・医学系研究に関する倫理指針】に従う試験(国立がん研究センター研究倫理審査委員会(NCC-IRB)を利用)は一括審査となりますので、プロトコール改訂が承認された後、CRBもしくはNCC-IRBへ変更申請を行います。変更申請の手続きについては、JCOG運営事務局よりご連絡します。変更申請承認後、審査資料一式をお送りしますので、参加施設へ変更箇所に関する研究実施許可申請の依頼をお願いします。
- 【人を対象とする医学系研究に関する倫理指針】に従う試験(自施設のIRBを利用)は、参加施設、協力施設(患者登録有りの場合)、診療分担施設にプロトコール改訂/改正箇所を周知し、IRB再審査申請の依頼をお願いします。登録適格性確認票・CRFの変更点についても周知をお願いします。
- プロトコール改正時には、各参加施設より改正プロトコールに対するIRB承認書/医療機関管理者の許可書のコピーをJCOGデータセンターへご提出いただきます。Web画面(『CRB/IRB・バイオバンク承認書類申請・確認画面』)よりご提出ください。グループメーリングリストを通じて、改正プロトコールの承認書/許可書提出施設をお知らせしますのでご確認をお願いします。
- プロトコール改訂審査や中間解析審査等で患者登録が一時中止となったり、その後再開される際は、参加施設、協力施設(患者登録有りの場合)、診療分担施設へすみやかにアナウンスをお願いします。
3. JCOG臨床試験追加施設の連絡
試験開始当初は当該試験への参加を予定していなかった施設が、後から参加を表明した場合は、試験毎に手続きをお願いいたします。
- 【臨床研究法】に従う試験(CRB)
プロトコール改訂が必要となります。次回改訂の際にJCOG運営事務局まで追加施設をお知らせください。 - 【人を対象とする生命科学・医学系研究に関する倫理指針】に従う試験(一括審査IRB)
国立がん研究センター研究倫理審査委員会へ申請が必要となります。追加施設をJCOG運営事務局までお知らせください。手続き方法をご案内いたします。 - 【人を対象とする医学系研究に関する倫理指針】に従う試験(施設IRB)
JCOG臨床試験追加施設連絡票をJCOGデータセンターまでご提出ください。詳細は、「JCOG臨床試験追加施設の連絡」をご覧ください。
4. PET/CT装置で撮像されたCT画像の取り扱い
PET/CT装置によって撮像されたCT画像を適格性の判断や効果判定に用いるには、施設におけるPET/CTの撮像条件について画像委員会の承認を得る必要があります。その場合には、画像委員会 の「PET/CT装置で撮像されたCT画像の取り扱いについて」に従って、「PET/CT装置で撮像されたCT画像診断能確認書」を画像委員会宛に送付して手続きを進めてください。
5. 研究事務局レビュー/モニタリングレポート検討
- 研究事務局レビュー/モニタリングレポート検討のため、年2回程度、定期モニタリングレポート受領後、JCOGデータセンターまでお越しください。zoom開催の場合はweb形式で行います。
- 研究事務局レビューの日程は、担当データマネージャーにご相談ください。
- JCOGデータセンターまでお越しいただく場合、旅費を支給いたします。担当データマネージャーから送付される会議案内にしたがってお手続きください。
6. 有害事象報告
- 施設で緊急報告の対象となる有害事象が発生した場合は、施設研究責任者から研究事務局に報告されます。詳細な手順は、プロトコールおよび研究者の手引き「有害事象報告」をご覧ください。
- 有害事象報告審査依頼は研究事務局より行っていただきます。次の点にご留意のうえ、必要書類を効果・安全性評価委員会事務局へご提出ください。
- 当該施設からの報告内容に不備がないことを確認してください。情報が不足している場合には、研究事務局から当該施設へ問い合わせ、情報を入手してください。
- 患者さんを特定できる情報(カルテ番号、氏名、イニシャル等)が報告書に記載されている場合は、必ずマスキングしてください。
- 当該施設からの報告書に加え、当該有害事象に対する研究代表者/研究事務局の意見(プロトコール改訂や登録一時中止等の必要性、今後の対応予定など)を記載したJCOG有害事象審査依頼書/意見書を添えてご提出ください。
- 死亡またはGrade 4の有害事象の場合、報告を受けた後、すみやかに必要書類をまとめて効果・安全性評価委員会事務局へご提出ください。
- 効果・安全性評価委員会に対する審査依頼(有害事象報告書類の送付)は、紙媒体の郵送、電子媒体のメール送信のいずれでも差し支えありませんが、特にメールの場合は誤送信のないよう十分ご注意ください。
- 審査結果は、当該施設をはじめ、グループ内で適切に情報共有してください。
- 効果・安全性評価委員会の審査・勧告内容を試験参加全施設(協力施設、診療分担施設を含む)の施設研究責任者に文書(電子メール可)にて通知すると同時に、各医療機関の長へご報告いただくようあわせてお伝えください。
ダウンロード書式
有害事象報告の各種書式はこちらからダウンロードしてご使用ください。
7. 試験中止手続き
- 中間解析で効果・安全性評価委員会より当該試験の中止勧告が出され、中止勧告を受諾する場合は、研究代表者・グループ代表者連名で効果・安全性評価委員会へ試験中止報告を行ってください。また、試験中止報告書には、試験中止日を記載してください。「○年○月○日をもって試験中止とします」と記載された日付が「試験中止日」となります。中止勧告を受諾しない場合もその理由を効果・安全性評価委員会まで文書でご報告ください。
- グループが自ら試験中止を希望する場合は、プロトコール改訂として、研究代表者・グループ代表者連名で効果・安全性評価委員会へご申請ください。
- 中止に関する報告書類はいずれも効果・安全性評価委員会事務局にご提出ください。
8. 研究終了手続き
- 最終解析レポートが、データセンターより研究事務局、研究代表者、グループ代表者、グループ事務局、効果・安全性評価委員会、JCOG代表者へ提出された日をもって、「研究終了」となります。
- 研究代表者/研究事務局は結果の概要とともに研究が終了したことの報告を参加施設の研究者に対して行ってください。
9. 主要評価項目報告書および総括報告書作成と提出
- データセンターより主たる解析レポートまたは最終解析レポートが提出されましたら、主要評価項目報告書または総括報告書を作成の上JCOG運営事務局 サイエンス部門までご提出ください。作成にあたっては、「主要評価項目報告書テンプレート」「総括報告書テンプレート」をご参照ください。また、論文化されている場合には、公表論文もあわせてご提出ください。詳細は、「主要評価項目報告書/総括報告書」をご覧ください。
- 臨床研究法下で実施した試験では、主要評価項目報告書および総括報告書は、JCOG運営事務局を通じて認定臨床研究審査委員会に提出いたします。
- 人を対象とする生命科学・医学系研究に関する倫理指針下で実施した試験はJCOG運営事務局で保管いたします。
- 総括報告書の認定臨床研究審査委員会承認、またはJCOG運営事務局への提出日が「JCOGにおける研究管理終了日」となります。この日をもちましてJCOG試験責任者メーリングリストから当該研究代表者・研究事務局の先生方を外させていただきます。
ダウンロード書式
主要評価項目報告書テンプレート
総括報告書テンプレート
「JCOGポリシー25 主たる解析・最終解析と総括報告書」も、ご参照ください
10. 論文化/学会発表
- 試験が終了した後は、必ず論文化し、結果を公表してください。
- 論文投稿の際は、事前にJCOGデータセンター/運営事務局にてレビューを行いますので、JCOGデータセンターに予めご相談ください。JCOGデータセンターに送付する前に、研究代表者、グループ代表委員(1名以上)によるレビューを受けてください。
- 学会発表をご希望の際は、抄録提出前にJCOGデータセンター に予めご相談ください。
- 詳しくは、JCOGポリシー「26 結果の公表」をご覧ください。
11. JCOGホームページでの結果公開
- 論文化後に総括報告書および論文の書誌事項をJCOGホームページの「臨床試験結果の公開」へ掲載します。
- 論文化しないことが確定している場合は、総括報告書をすみやかに公開します。
12. メタアナリシスへのデータ提供
- メタアナリシスへのデータ提供を行う場合には、グループ代表者の承認を得た上でJCOGデータセンターに予めご相談ください。
- データ提供の前に、効果・安全性評価委員会の承認が必要です。グループ代表者のサインのある専用の審査依頼書および添付資料を効果・安全性評価委員会事務局までご提出ください。
ダウンロード書式
13. 研究代表者/研究事務局変更
- コンセプト承認後に研究代表者や研究事務局を変更する場合にはグループ代表者の承認が必要となります。
- グループ代表者の承認を得た上、専用の変更届に必要事項を記入し、電子媒体でJCOG運営事務局までお送りください。
ダウンロード書式
JCOG研究代表者・研究事務局 変更届け
JCOG研究代表者・研究事務局 変更届け記入例
