FAQ 臨床研究法・CRB手続き
- TOP
- 研究者・医療関係者の皆さん向け
- 手引き
- 研究者
- FAQ 臨床研究法・CRB手続き
FAQ 臨床研究法・CRB手続き
FAQ 臨床研究法・CRB手続き目次
臨床研究法・CRB手続き
新規申請
質問1:機関内のCOI事実確認で、プロトコールと説明文書が必要ですので、ファイルを送ってください。
回答:
研究事務局から送付される、CRBへの申請手続きに関わる案内メールに、ファイル共有ツールのリンクが記載されています。プロトコールと説明文書はファイル共有ツールからダウンロードしてください。
変更申請
質問2:数か月後に研究者の異動予定があります。今、CRB変更申請手続きの案内が届いていますが、研究責任医師や研究分担医師の追加や削除を行ってよいですか?
回答:
すでに異動が決まっている研究者は今回の変更申請で手続きしてください。
ただし、手続きが可能なのは、「在籍中」の研究責任医師/研究分担医師の交代、追加、削除のみです。施設内でのCOI申告・確認が必要となりますので、今後着任して来られる先生の追加は着任後しか手続きを行えません。
実際に医師の追加、削除が反映される時期の目安について:研究事務局から配信される変更申請の案内メールにCRBの開催予定日が記載されています。CRB承認後に管理者許可を得ていただく等、手続きを行いますので、大体、CRBの3週間~4週間後に変更が反映されます。変更が反映される時期も考慮していただき、手続きをお願いします。
質問3:変更申請のCRB提出書類をアップロードして提出しましたが、その後に提出を求める督促メール(メール件名:【臨床研究法リマインド】)が届きました。アップロードが完了しているかどうか確認する方法をおしえてください。
回答:
該当するメールでお伝えしている情報には、申請内容によって以下の2つのパターンがあります。
①「書類未提出の施設を記載している」場合
(メールに【提出必須の1-3、1-4が未提出:XX施設】と記載あり)
②「書類提出済の施設を記載している」場合
(メールに【書類提出済み:以下のXX施設】と記載あり)
メール本文で、①と②のどちらのパターンで施設名がリストされているかご確認いただき、①の場合は書類を改めてアップロードしてください。②の場合はアップロードが完了していますのでご安心ください。
質問4:今回の変更申請で研究分担医師を追加するため書類を提出しました。CRBで承認されるまでの間に「研究支援者」として登録すれば同意取得を行ってもよいでしょうか。
回答:
同意取得はCRBで承認された研究責任医師または研究分担医師でなければ行うことができません。
今回追加する研究分担医師は、CRB承認後にjRCTで変更が公表されると同意取得を行うことができます。
それまでの間は「研究支援者」としてEDCシステムでの調査票入力などをサポートいただくことは可能です。登録患者の担当医として選択可能になるのは、jRCTで変更が公表された後にデータセンターのシステム上で追加の承認が完了した後になります。 jRCTで変更が公表されるまでの間に、プロトコール治療に関わってもよいかどうかは施設内の方針に従ってください。
質問5:現在、研究責任医師1名と研究分担医師1名の2名体制で実施しています。研究分担医師が異動することになったので、研究分担医師を削除して、研究責任医師1名のみとしてよいですか?
回答:
研究分担医師は1名以上を配置してください。
今後、研究責任医師が何らかの理由で急に不在となる場合もあり得るため、研究責任医師が一定期間不在となっても研究分担医師によって研究管理体制が維持され、生存中の登録患者の診療体制が確保されるように、必ず1名以上の研究分担医師の配置をお願いします。
質問6:プロトコールと説明文書の両方の改訂がCRBで承認されました。改訂後のプロトコールと説明文書はいつから用いることができますか。
回答:
プロトコールの改訂内容は、CRB承認後に各実施医療機関の管理者の許可を得て、その後にjRCTで公表されると発効されます。JCOG試験では管理者許可を得ていただく期間として2週間程度を確保していますので、この間に速やかに管理者の許可を得てください。
グループメーリングリストで改訂発効の連絡がありますので、それまでは改訂前のプロトコールに従い、改訂発効の連絡後は改訂後のプロトコールに従ってください。
なお、説明文書は、必ず機関内の管理者の許可が得られたバージョンを使ってください。もし機関内の手続きが遅れて改訂発効日までに管理者の許可が得られていない場合は、管理者許可が得られてから新しいバージョンの説明文書を用いていただくようにお願いいたします。
質問7:つい先月、当該試験の変更申請について管理者許可を得たところです。今回、研究事務局より次の変更申請の案内メールを受領しました。また何か対応が必要でしょうか。
回答:
JCOG試験の1回の変更申請にかかる期間は、各施設での書類作成に必要な期間やCRBの審査期間も含めて約半年で、基本的に年2回を予定しています。そのため、前の変更申請が終わった直後に次の変更申請の案内が届きます。
今回受領した案内メールをご確認いただき、対応が必要な該当事項がありましたら、書類の作成と提出をお願いします。
質問8:今月から当院に新たに医師が着任しました。早速、研究分担医師に追加したいので、変更申請に必要な書類の提出を進めてもよいでしょうか。
回答:
各試験の研究事務局からグループメーリングリストを通じて連絡される変更申請の案内メールがあるまで手続きはせずにお待ちください。
JCOG試験では基本的に年2回のペースで変更申請を行っていますので、試験ごとに研究分担医師を追加できる変更申請のタイミングが異なります。また、当該試験の変更申請に必要な様式の内容が更新されることがありますので、案内メールを確認後、手続きを進めてください。
CRB変更申請の手続きを行い承認されるまでの間は、「研究支援者」としてEDCシステムでの調査票入力などをサポートいただくことは可能です。JCOG Web Entry Systemの役割登録画面で「研究支援者(研究)」として登録していただくと、直ちに役割が反映されます。
質問9:再来月から当院の「施設名」が変更されます。現在作成中の変更申請の提出書類の締切が来月のため、変更後の施設名を記載して提出したらよいでしょうか。
回答:
「施設名」の変更について、「保険医療機関名」に変更があるかどうか院内の担当部署にご確認ください。臨床研究法では「保険医療機関名」をCRB提出書類に記載して提出していますので、「保険医療機関名」に変更がある場合は、「保険医療機関名」の変更届出が正式に完了後のCRB変更申請で施設名を変更して書類を提出してください(※)。
現在作成中の変更申請の提出書類では、施設名は変更せずに提出してください。
なお、臨床研究法の変更申請とは別に、JCOGに届け出ている医療機関名の変更が必要な場合は、JCOGホームページ「医療機関情報変更/施設情報変更」をご参照ください
(※)保険医療機関名については、変更後の名称を地方厚生局のウェブサイトで確認したのち、CRBへ変更書類を提出します。確認がとれない時点では、元の施設名のまま手続きを行います。次回の変更申請で、あらためて施設名を修正してください。
質問10:先進医療の試験で、研究責任医師を変更したいです。研究事務局から届いたCRB変更申請の案内メールには、「先進医療の手続きが必要」と記載されていましたが、どうしたらよいでしょうか。
回答:
研究事務局から届いた案内メールに沿って、変更後の実施計画、研究分担医師リスト、COI管理様式の作成をお願いします。
研究責任医師の変更にあたっては、必ず、プロトコール13章の「本試験における研究責任医師、実施医療機関の要件」を確認のうえ、要件を満たしている医師を研究責任医師としてください。
また、臨床研究法の手続きとは別に、先進医療に関する変更届出の手続きが必要となりますので、案内メールに記載の「JCOG先進医療調整事務局」宛に変更についてメールでご連絡ください。手続き前に要件を確認する必要がありますので、はやめにご連絡ください。
質問11:変更申請のCRB提出書類について、当院の手続きが遅れており、期限までに提出できません。
回答:
提出期限までに間に合わない場合は、今回の変更申請に含めることができません。次回の変更申請のご案内をお待ちください。
質問12:当該試験の研究グループに所属していない診療科の医師にも参加いただくことは可能でしょうか。
回答:
はい、可能です。ただし、同意取得等を行う場合は、「研究分担医師」として追加するためCRBへの変更申請が必要です。次回の変更申請のご案内に従って手続きをお願いします。
同意取得を行わず、当該試験のプロトコールに従って検査や治療のみを行う場合、「研究分担医師」として追加が必要かどうかは、院内の規程に従ってください。
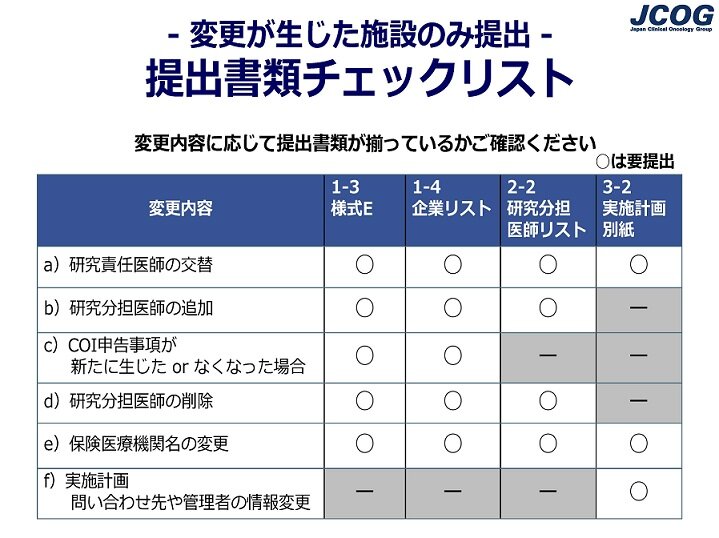
質問13:変更申請手続きについて、研究事務局から受領した案内メールに「変更が生じた施設のみ対応」と記載されていました。前回から変更はないと思いますが、書類の提出が必要かどうか、心配です。
回答:
【変更が生じた施設のみ対応する場合】
まず、現在CRBで承認されている自施設の情報より、変更有無をご確認ください
<実施計画(jRCT)> については、以下のいずれかの方法より、現在の自施設の登録情報を確認してください。
・ 3-2実施計画別紙(エクセル)で確認
・ JCOGウェブサイト 試験一覧 の各試験の「臨床試験登録」のリンクよりjRCTへアクセスして確認
<研究分担医師リスト、COI管理様式E/企業リスト> については、「JCOGファイル管理ツール」 内に施設ごとに保存している最新のCRB承認版ファイルをご覧いただき、変更が生じているかをご確認ください。
JCOGファイル管理ツール https://file.jcog.jp/
提出書類の要不要をまとめた、下図の「提出書類チェックリスト(変更が生じた施設のみ提出)」をご参照のうえ、左の変更内容( a~f )に該当する場合は、右の「○」(要提出)がついている書類を作成し、ご提出ください。
ご提出いただく、1-3COI管理様式E、1-4企業リスト、3-2実施計画別紙の書式は研究事務局からの案内メールにダウンロード先が記載されています。2-2研究分担医師リストはWeb Entry Systemの役割登録画面より出力していただきますので、書式はありません。
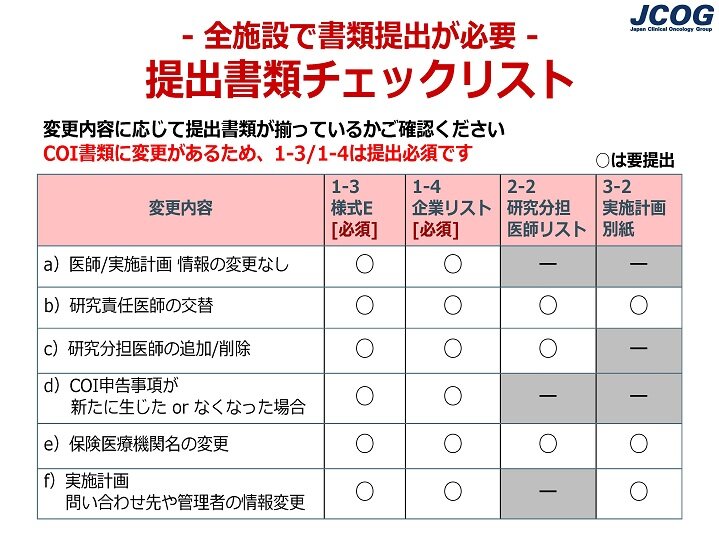
質問14:変更申請手続きについて、研究事務局から受領した案内メールに「全参加施設でCOI書類の作成、提出が必要」と記載されていました。COI書類は全施設提出必須とありますが、他の書類も提出が必要でしょうか?
回答:
【全参加施設でCOI書類の作成、提出が必要な場合】
今回は、COI申告対象企業等に変更が生じたため、全参加施設でCOI書類(1-3COI管理様式E、1-4企業リスト)の作成、提出が必須となります。
それ以外の書類に関しては、まず、現在CRBで承認されている自施設の情報より、変更有無をご確認ください。
<実施計画(jRCT)> については、以下のいずれかの方法より、現在の自施設の登録情報を確認してください。
・ 3-2実施計画別紙(エクセル)で確認
・ JCOGウェブサイト 試験一覧の各試験の「臨床試験登録」のリンクよりjRCTへアクセスして確認
<研究分担医師リスト> については、「JCOGファイル管理ツール」 内に施設ごとに保存している最新のCRB承認版ファイルをご覧いただき、変更が生じているかをご確認ください。
JCOGファイル管理ツール https://file.jcog.jp/
提出書類の要不要をまとめた、下図の「提出書類チェックリスト(全施設要提出) 」をご参照のうえ、左の変更内容( a~f )に該当する場合は、右の「○」(要提出)がついている書類を作成し、ご提出ください
ご提出いただく、1-3COI管理様式E、1-4企業リスト、3-2実施計画別紙の書式は研究事務局からの案内メールにダウンロード先が記載されています。2-2研究分担医師リストはWeb Entry Systemの役割登録画面より出力していただきますので、書式はありません。
管理者許可申請
質問15:管理者への研究実施許可申請で提出したCRB承認書類の中で「CRB承認日」が未記載の書類があり、承認日を記載するように指示がありました。承認日が記載された書類をください。
回答:
管理者許可を得ていただく際にご案内している「認定臨床研究審査委員会(CRB)承認書類ダウンロード」ページに掲載している書類は、CRB承認日が記載されていません。
CRB承認日が記載された書類は以下の資料掲載ページよりダウンロードしてください。
・ 研究計画書、説明同意文書
プロトコールダウンロードページ
https://secure.jcog.jp/dc/doc/member/protocol/
・ 個人COI開示_ウェブサイト公開原稿
⇒該当する試験の行で、最右端の「利益相反」のPDFアイコンをクリックしてください。JCOGウェブサイトの更新が月に1回のため、最新版への更新が次月となる場合があります。
質問16:これまでCRBで審議された審査書類を入手する方法をおしえてください。
回答:
新規申請や変更申請のCRB審査書類は専用のCRB承認書類ダウンロードページに掲載していますので、下記サイトからダウンロードしてご利用ください。
質問17:研究事務局から受領した案内メールで「各実施医療機関の管理者に厚生労働大臣へ実施計画を提出した旨の報告が必要」とあります。CRB承認後の管理者許可申請は行いましたが、これとは別に管理者への報告が必要でしょうか。
回答:
臨床研究法施行規則に従ってご案内しています(臨床研究法施行規則 第39条 第4項)。
報告の方法や内容については機関内の担当部署にご確認ください。
(参考:実施計画を厚生労働大臣に提出すると、jRCTで研究情報が公表されますので、jRCT登録情報を報告する施設が多いようです。)
質問18:臨床研究法では全施設で同じ説明同意文書を用いなければならないと聞いています。説明同意文書に書き換え可能な箇所や選択肢がありますが、管理者許可を得る際にこれらの部分はどうしたらよいのでしょうか。
回答:
施設ごとに変更可能な章は、施設の情報を反映して選択、追記してから、管理者許可を得てください。許可が得られた文書を実際に使用していただきます。
なお、以下の章以外は改変不可です。
<変更可能な章>
・ 費用
・ プライバシーの保護について(個人情報)
・ 当院の研究責任医師、相談窓口、研究代表医師、研究事務局の連絡先)
質問19:CRB承認書類の中の説明文書、同意書の後ろに「別紙:臨床試験に伴う副作用・合併症について」がついています。この文書についても管理者許可を得る必要がありますか。また、管理者許可を得る必要がある場合、当施設で使うファイルはどこにありますか。
回答:
別紙も説明文書、同意書とあわせて患者さんへ渡す書類となりますので、管理者許可を得てください。
プロトコールダウンロードページの「最新」の欄に「◎」があるバージョン番号をクリックして表示されるページに、最新版の文書が掲載されています。説明文書・同意書と別紙は1ファイルとして統合されています。
プロトコールダウンロードページ
・ 「説明文書・同意書(IC文書別紙含む)」
質問20:jRCTに公開される時期(改訂発効となる時期)はいつでしょうか。
回答:
CRBで承認され、その後に各実施医療機関で実施許可を得ていただきます。その後、jRCTで公表されると、グループメーリングリストを通じて周知されますので案内メールをお待ちください。
質問21:書類を作成し、当科の担当者がJCOGへ提出しましたが、提出者が異動となった関係で、CRBへの最終提出書類が分からなくなってしまいました。自施設の管理者許可を得る際に、様式Eの提出が必要と言われていますが、どうしたらよいですか?
回答:
CRBで承認された各施設のCOI管理様式Eと企業リストについては、「JCOGファイル管理ツール」 内に施設ごとに保存しています。下記URLより、ログインのうえ、ご自身の施設の最終版ファイルをダウンロードしていただき、管理者の研究実施許可を得てください。
JCOGファイル管理ツール https://file.jcog.jp/
トップページの左側より、グループ名を選ぶと、試験番号 「JCOGXXXX」ごとにCRB承認資料が表示されます。該当するCRB承認日(「CRB承認資料_YYYYMMDD 」)をクリックすると、書類が展開されて表示されます。
提出書類について
COI管理様式
質問22:COI管理様式の様式Cについて教えてください。前年度、今年度について申告しますが、年度の区切りは決まっていますか?
回答:
一般に、COI申告の年度は「4月1日~3月31日」となります。
(例) 前年度 : 2019年4月~2020年3月
今年度 : 2020年4月~現在まで
ただし、上記以外の年度の区切りで管理をされている場合は、ご施設で採用されている年度でかまいません。
質問23:【変更申請】研究分担医師を追加する場合、COI管理様式Cと様式Eには追加の医師のみ記載して提出すればよいでしょうか。
回答:
JCOG運営事務局へ提出する様式Eには、既に提出済みの他の分担医師と、今回追加となる医師をすべて記載してご提出ください。
施設内の事実確認で確認部署に提出する様式Cにどのように記載するべきかは、施設内の規程に従ってください。
質問24:COI管理様式の様式Eを提出しようと思いますが、様式Cなどの他のシートを削除しようとすると、様式Eの記載もリンクが反映されず、消えてしまいます。どうすればいいでしょうか。
回答:
JCOG運営事務局へ提出するCOI管理様式は様式E以外のシートが含まれたまま提出いただいて差し支えありません。CRBには各施設の様式Eのみ提出します。
1医療機関につき、様式Eを含む1ファイルをご提出ください。
質問25:当院の研究責任医師と研究分担医師は計16名を超えていて、様式Eの記載欄に全員を記載できません。どうしたらよろしいでしょうか。
回答:
様式Eの1つのファイルに記載できる研究責任医師と研究分担医師は計16名までです。17名以上となる場合、2つのファイルに分けて作成してください(1つのファイルに様式Eのシートは追加しないでください)。
1つめのファイルの様式Eでは、左上の表(立場・氏名)に研究責任医師と15名の分担医師をご記載ください。
2つめのファイルの様式Eでは、左上の表(立場・氏名)に残りの分担医師をご記載ください。
右上の医療機関名と責任医師名の記載は両方ともご記載ください。
質問26:院内のCOI事実確認の結果、研究責任医師が「基準1と4と5」に該当しました。基準4には「原則として、研究責任医師にならないこと」とありますが、研究責任医師は変更せずに、そのまま様式Eを提出してもよいでしょうか。
回答:
JCOG試験の審査を行うCRBの方針で「基準1と4と5」に該当する研究責任医師は、原則、研究責任医師になることができません。
そのため、基準4に該当しない他の医師へ研究責任医師の交代をお願いします。交代ができない場合は、「やむを得ず交代できない理由」がCRBから求められますので、様式Eの右上の【特記事項(任意)】欄へご記載ください。
記載例1:研究責任医師が管理基準4に該当し交代を検討したが、人員が限られ研究責任医師の責務を果たせる医師が他にないため、基準5を満たすことで研究責任医師になることとした。
記載例2(先進試験など、要件が細かく定められている場合):研究責任医師が管理基準4に該当し交代を検討したが、本試験で規定される研究責任医師の要件を満たす医師が他にいないため、基準5を満たすことで研究責任医師になることとした。
記載例2の研究責任医師の要件は、当該試験のプロトコール13章でご確認ください。
質問27:【変更申請】変更申請手続きについて、研究事務局から受領した案内メールに「企業リスト」に変更があると記載されていました。
これまで申告していた研究責任医師や研究分担医師に変更はなく、COIの有無も変更はないので、何も提出しなくてよいでしょうか。
回答:
企業リストに変更がありますので、COI管理様式Eと企業リストの提出が必要です。
企業リストの変更内容(下記の例参照)に応じて、施設内の事実確認が必要かどうかは、施設内の確認部署にご確認ください。
(例1)企業に追加あり:追加企業について施設内の事実確認を行ってください。
(例2)企業に削除あり:施設内の確認部署に手続きをご確認のうえ、COI管理様式Eを作成してください。
質問28:【変更申請】変更申請手続きについて、研究事務局から受領した案内メールに「変更が生じた施設のみ対応」とありましたが、企業リストについて、「今回、企業について以下の社名変更があります」と記載されていました。これまで申告していた研究責任医師や研究分担医師に変更はなく、COIの有無も変更はないので、何も提出しなくてよいでしょうか。
回答:
はい、書類の提出は必要ありません。
ただし、研究責任医師や研究分担医師に変更がある場合やCOIの内容に変更がある場合は、企業名が更新された新しい企業リストを使用してCOI管理様式Eと企業リストの作成と提出をお願いします。
研究分担医師リスト
質問29:役割登録画面で役割を選択したいのですが、役割のボタンを押すことができません。
回答:
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の「研究責任医師」のみとなります。
役割登録の設定以外で、研究分担医師リストのダウンロードはどのユーザーでも行うことができます。
質問30:研究分担医師を追加したいです。役割登録画面で「変更後の本試験の役割」を研究分担医師に設定しましたが、右側の「CRBによる承認」欄が承認となりません。
回答:
「CRBによる承認」欄はCRB承認後に承認済となります。申請前は空欄のままで問題ありませんので、研究分担医師リストダウンロードボタンより、研究分担医師リストを作成し、提出をお願いいたします。
質問31:【変更申請】私は「研究分担医師」として登録されています。研究責任医師を変更するために研究分担医師リストを作成したいのですが、役割登録画面で該当する医師を選択することができません。
回答:
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の現在の役割が「研究責任医師」のみです。
役割登録の「現在の本試験における役割」の画面で、施設内でどなたがこれらの役割を有しているか確認できますので、いずれかの役割の方に設定を依頼してください。
研究ごとの役割の登録については、「研究ごとの役割登録(研究責任医師・分担医師・支援者)に関する手順と説明 」をご覧ください。
質問32:【変更申請】今回新たに「研究分担医師」を追加したいです。役割登録画面で追加したい医師が表示されず選択できません。
回答:
役割登録画面で追加したい人が表示されない場合は、先に「研究者情報変更 」の手続きが必要です。施設研究責任者、もしくは施設コーディネーターから研究者登録をご申請ください。詳細は、「研究者情報変更」をご覧ください。
研究者情報変更の手続きが完了すると、追加した医師が役割登録画面に表示されますので、「研究分担医師リスト」の作成、提出をお進めください。
質問33:役割登録画面から、研究分担医師リストのエクセルファイルをダウンロードしました。新たに研究分担医師に追加したい医師がいるため、エクセルで手入力して追加してもよいですか?
回答:
研究分担医師となるには、JCOGへの研究者登録と、役割登録画面での役割設定が必要となります。エクセルファイルへの手入力による追加はお控えください。
この上の4番の回答を参照していただき、研究者登録から手続きを進めてください。
質問34:【変更申請】胃がんグループと食道がんグループのインターグループスタディで研究分担医師を変更したいです。私は胃がんグループの施設コーディネーターですが、当該試験の研究責任医師ではありません。
役割登録画面で、私が所属する胃がんグループの研究分担医師については変更後の役割を登録できましたが、食道がんグループの研究分担医師は画面に表示されず登録ができません。
回答:
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の現在の役割が「研究責任医師」のみです。
食道がんグループの施設研究責任者、施設コーディネーター、または研究責任医師に設定を依頼してください。
質問35:【変更申請】胃がんグループと食道がんグループのインターグループスタディで、研究責任医師を胃がんグループの医師から、食道がんグループの医師へ変更したいのですが可能ですか。
回答:
はい。
役割登録画面で役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の現在の役割が「研究責任医師」のみです。
胃がんグループの現在の研究責任医師、または、食道がんグループの施設研究責任者、施設コーディネーターが設定を行ってください。
食道がんグループの医師を研究責任医師に設定した際は、必ず胃がんグループの役割登録画面でも、現在の研究責任医師の役割を「なし」もしくは「研究分担医師」へ変更してください。
質問36:【放射線治療グループと頭頸部がんグループのインターグループスタディですが、当院は頭頸部がんグループからしか参加していません。放射線科の医師を研究分担医師に追加したいですが、どうしたらよいですか?
回答:
ご施設の頭頸部がんグループの研究者に放射線科の医師を追加していただくことが可能です。
頭頸部がんグループの施設研究責任者、もしくは施設コーディネーターより研究者登録の手続きを行ってください。手続きの詳細は、「研究者情報変更 」をご覧ください。
研究者情報変更(追加)の手続きが完了すると、追加した医師が役割登録画面に表示されますので、「研究分担医師リスト」の作成、提出をお進めください。
質問37:【変更申請】異動した医師がいます。JCOGデータセンターへ登録している研究者情報は削除の手続きを行いました。役割登録画面を確認すると、すでに該当する医師は削除されていますが、CRB変更申請の書類提出は必要でしょうか。
回答:
はい。
JCOGデータセンターへの手続きとは別にCRBへの変更手続きも必要となります。現在CRBで承認されている研究分担医師リストに、当該研究分担医師が掲載されていますので、記載を削除した研究分担医師リストを提出する必要があります。
「臨床研究法対応試験 関連書類 」に掲載している手順書を参照して研究分担医師リストの作成と提出をお願いします。
手順書p17以降の④→⑦→⑧→⑨の順番で進めてください。
(役割登録画面で既に当該医師が削除されていますので、手順書の⑤、⑥の操作は必要ありません。)
また、COI管理様式Eも作成と提出が必要ですので、上記の手順書27ページ以降をご参照ください。
なお、COI管理様式Eを変更する場合、あらためて機関内でCOI申告と事実確認を行うかどうかは、機関内の規程に従ってください。
質問38:【変更申請】変更申請手続きについて、研究事務局から受領した案内メールに「研究分担医師リスト」の作成用のファイルが添付されていませんでした。ファイルを送ってください。
回答:
研究分担医師リストはWeb Entry Systemで必要事項を入力してご作成いただく必要があります。
「臨床研究法対応試験 関連書類 」に掲載している手順書のp9-25を参照して研究分担医師リストの作成と提出をお願いします。
【手順書p9-25ページの概要】
1)Web Entry System にログインしてください
2)「役割登録(研究責任医師・分担医師・支援者)」の画面に進んでください(p16-17)
3)「役割の追加/変更/削除」画面で(p18)、「変更後の本試験における役割」で変更内容をチェックしてください(p20-21)
なお、「役割登録」の操作が行えるユーザーは、該当するグループの施設研究責任者、施設コーディネーター、現在の研究責任医師のみです。
4)「研究分担医師リスト」をダウンロードしてください(p22)
質問39:【変更申請】これから変更申請で研究分担医師の削除を予定しています。Web Entry Systemで研究分担医師リストを作成した時点で、患者登録やCRF入力ができなくなるのでしょうか。
回答:
現在の役割は、CRBで変更申請が承認され、その後にjRCTに公表されるまで有効ですので、それまでは患者登録やCRFの入力が可能です。
質問40:【変更申請】研究分担医師の追加のため、Web Entry System役割登録画面で「変更後の本試験の役割」を研究分担医師に設定したところ、倫理指針に従う試験ではすぐに「現在の本試験における役割」に反映されましたが、臨床研究法に従う試験では「CRBによる承認」欄が承認となりません。
回答:
倫理指針に従う試験では、JCOGの研究者登録完了後すぐに、役割の追加が「現在の本試験における役割」に反映されます。一方、臨床研究法に従う試験では、役割の追加はCRBでの承認を経てから反映されますので、CRB承認までお待ちください。
質問41 :jRCT公表、改訂発効の案内メールが届きましたが、今回研究分担医師リストへ追加した医師が担当医として選べません。
回答:
役割登録画面を開いて、「研究グループ」、「施設」、「該当する試験」を選択していただき、下に表示される「役割の追加/変更/削除画面」を押してください。
その画面で、研究分担医師リストへ追加した医師氏名が表示されているかご確認ください。
氏名が表示されている場合は、JCOG側のシステムの不備がありえますので、お問い合わせページ の「お問い合わせ先一覧」に記載の、JCOGデータセンターまでご連絡ください
氏名が表示されていない場合は、JCOG研究者登録の手続きが完了していない場合がありますので、施設研究責任者、もしくは施設コーディネーターから研究者登録をご確認のうえ、申請をお願いします。手続きの詳細は、「研究者情報変更 」をご覧ください。
質問42 :食道がんグループの試験ですが、プロトコール治療には放射線治療や内視鏡治療も含まれています。当科(消化器内科)の医師以外に、放射線治療科、内視鏡科の医師を研究分担医師として追加したいです
回答:
ご施設の食道がんグループの研究者に放射線治療科や内視鏡科の医師を追加していただくことが可能です。
食道がんグループの施設研究責任者、もしくは施設コーディネーターより研究者登録の手続きを行ってください。手続きの詳細は、「研究者情報変更 」をご覧ください。
研究者情報変更(追加)の手続きが完了すると、追加した医師が役割登録画面に表示されますので、「研究分担医師リスト」の作成、提出をお進めください。
実施計画別紙
質問43 :【変更申請】「管理者」として登録している病院長が変更になりました。今すぐ変更の手続きが必要でしょうか。
回答:
変更手続きは試験ごとに時期を決めて定期的に行っていますので、研究事務局からの変更申請の案内メールをお待ちください。
変更申請の案内メールを受領したら、案内メールにファイル共有ツールのリンクが記載されていますので、ファイル共有ツールから「実施計画別紙」ファイルをダウンロードしていただき、ファイルを開いてご施設の情報「研究責任医師の所属する実施医療機関の管理者の氏名」を赤字で変更して提出してください。
質問44 :【変更申請】当院の「管理者」が変更になりました。一度連絡すれば、全ての試験で当院の管理者の変更手続きを行ってもらえますか?
回答:
病院長の変更につきまして、試験毎に、実施計画(jRCTに公表される情報)を修正する必要があります。
参加している試験毎に変更書類のご提出をお願いいたします。
変更書類は、試験毎に順次ご案内している、変更申請の案内メールをお待ちください。
質問45 :【変更申請】jRCTに公表されているe-Rad番号やFAX番号を非公開に変更したいです。修正できますか?
回答:
はい。
jRCTに公表される情報のうち、e-Rad番号とFAX番号は任意記載項目のため、非公開にできます。
変更申請の案内メールを受領したら、メールに添付されている、「実施計画別紙」ファイルを開き、ご施設の情報のe-Rad番号とFAX番号を削除して提出してください。
質問46 :【実施計画の「研究に関する問合わせ先」は誰がいいのでしょうか。施設コーディネーターとしたほうがよいですか?
回答:
該当する試験の問い合わせに対応される方を記載してください。研究責任医師や研究分担医師、JCOG施設の施設研究責任者や施設コーディネーターに限りません。機関内に設置されている相談支援センター等があれば、臨床研究に関する患者さん向け相談窓口の担当者でもかまいません。必ず、担当者の氏名を記載してください。氏名欄に部署名を記載しないでください。
書類提出(アップロード)
質問47 :CRB提出書類をアップロードしましたが、その後に変更点が生じました。提出期限はまだ先なので、更新した書類の提出方法をおしえてください。
回答:
更新した書類のみ、前回と同じ方法で再度アップロードをお願いします。
質問48 :胃がんグループと食道がんグループのインターグループスタディでCRB提出書類をアップロードしたいのですが、胃がんグループと食道がんグループのそれぞれから同一書類を提出したらよいですか?
回答:
どちらか一方のグループから1回アップロードをお願いします。
質問49 :新規申請や変更申請に必要な提出書類をアップロードしました。アップロードできているかどうか心配なので、自分で確認する方法をおしえてください。
回答:
アップロードできているかどうかは、以下のいずれかでご確認ください。
・ ファイルアップロードボタンを押した後に「アップロードが完了しました」のメッセージが表示されます。メッセージが表示されることをご確認ください。
書類提出期限前に試験毎にリマインドメールを定期的にお送りします(メール件名【臨床研究法リマインド】)。そのメールに提出済施設もしくは未提出施設が記載されていますので、そのメールの配信を待ってご確認ください。
案内メール、リマインドメールに関する質問
質問50 :当院は「JCOG協力施設」となり、当該試験で患者登録がなく、前回の変更申請で参加取り下げがCRBで承認されました。しかし、その後もグループメーリングリストで当該試験の案内メールが届きます。当該試験の案内メールを受信しないようにしたいのですが、どうしたらよいでしょうか。
回答:
当該試験の参加取り下げがCRBで承認された後も、他のJCOG試験にご参加いただいていて、グループメーリングリストのメンバーとして登録されている間は、グループメーリングリストを通じてご案内されるメールを止めることはできません。
ご不便をお掛けしますが、メール件名に記載される試験番号より、必要となるメールをご確認ください。
質問51 :当院が参加していない試験について、CRB申請に関わる案内メールや督促メールが届きます。当該試験の案内メールを受信しないようにしたいのですが、どうしたらよいでしょうか。
回答:
他のJCOG試験にご参加いただいていて、グループメーリングリストのメンバーとして登録されている間は、グループメーリングリストを通じてご案内されるメールを止めることはできません。
ご不便をお掛けしますが、メール件名に記載される試験番号より、必要となるメールをご確認ください。
質問52 :グループメーリングリストにメンバーとして含まれていないため、CRB申請に必要な案内メールが届きません。
回答:
ご施設内でメールを受領できている研究者にメールの転送を依頼してください。
グループメーリングリストのメンバーへ追加される場合は、ご施設の該当する研究グループへの研究者登録が必要です。施設研究責任者、もしくは施設コーディネーターからご申請ください。詳細は、「研究者情報変更 」をご覧ください。
説明文書・同意書
質問53 :説明文書の「プライバシーの保護について(個人情報)」の章で、イニシャル、生年月日、診療録番号について、選択肢が設けられています。試験ごとに各診療科で方針を決定して選択してよいでしょうか。
回答:
選択肢は、基本的に従来のご施設の方針と同じ項目をご選択ください(※)。選択事項①、②、③はCRBで承認された記載のため、選択事項の記載内容の変更はできません。
例1:これまでイニシャル、生年月日、診療録番号の3つすべてが使用可であった施設は、①イニシャル、②生年月日、③診療録番号をご選択ください。
例2:これまでイニシャルのみ使用不可であった施設は、①イニシャルの代わりとして一律XX、②生年月日、③診療録番号をご選択ください。
※ もし機関内で、個人情報の扱いの変更を求められた際には、従来どおりとするように検討をお願いします。
新たに診療録番号の使用を不可とするには、以下の①、②が必要です。
①医療機関の公式部門(治験管理室・臨床試験管理室等)にて診療録番号とは別の「登録用ID番号」を発行して管理すること(医局や診療科での自主管理は不可)
②「登録用ID番号の発行」手順、「登録用ID番号と診療録番号の対応表」の書式ならびにその管理・保管・修正方法に関する標準業務手順書をJCOGデータセンター長に提出すること(不備があれば修正が必要になります)
詳細は、JCOGポリシー「31 プライバシーポリシー 」
Page 6「4. 医療機関が診療録番号等の情報を外部に提供しない方針の場合の取り決め」をご確認ください。
質問54 :臨床研究法では全施設で同じ説明同意文書を用いなければならないと聞いています。説明同意文書に書き換え可能な箇所や選択肢がありますが、管理者許可を得る際にこれらの部分はどうしたらよいのでしょうか。
回答:
施設ごとに変更可能な章は、施設の情報を反映して選択、追記してから、管理者許可を得てください。許可が得られた文書を実際に使用していただきます。
なお、以下の章以外は改変不可です。
<変更可能な章>
・ 費用
・ プライバシーの保護について(個人情報)
・ 当院の研究責任医師、相談窓口、研究代表医師、研究事務局の連絡先)
質問55 :CRB承認書類の中の説明文書、同意書の後ろに「別紙:臨床試験に伴う副作用・合併症について」がついています。この文書についても管理者許可を得る必要がありますか。また、管理者許可を得る必要がある場合、当施設で使うファイルはどこにありますか。
回答:
別紙も説明文書、同意書とあわせて患者さんへ渡す書類となりますので、管理者許可を得てください。
プロトコールダウンロードページの「最新」の欄に「◎」があるバージョン番号をクリックして表示されるページに、最新版の文書が掲載されています。説明文書・同意書と別紙は1ファイルとして統合されています。
プロトコールダウンロードページ
・ 「説明文書・同意書(IC文書別紙含む)」
システム(ファイル管理ツール等)
質問56 :CRB承認書類が掲載されている「CRB承認書類ダウンロードページ」や当院のCOI管理様式Eが保存されている「JCOGファイル管理ツール」のサイトでログインができません。
回答:
JCOGへ施設研究者登録されている研究者がログイン可能となります。EDCでデータ入力される時と同じように JCOG Web Entry System のアカウント(登録メールアドレス)とパスワードでログインをお願いします。
システムを使用するにあたっては、「サポート対象webブラウザ 」 をご確認ください。
質問57 :JCOGファイル管理ツールを利用したいのですが「ユーザー名」と「パスワード」が要求されます。アカウントを作成する手続きをおしえてください。
回答:
JCOGの研究者登録がされている方は、EDCやWeb Entry Systemをご利用いただく際と同じ「ユーザー名」(メールアドレス)と「パスワード」をご利用ください。
JCOGの研究者登録がされていない方は、該当する研究グループへの研究者登録が必要です。施設研究責任者、もしくは施設コーディネーターからご申請ください。詳細は、「研究者情報変更 」をご覧ください。
質問58 :JCOG Web Entry Systemの役割登録画面やJCOGファイル管理ツールを開きましたが、画面に表示されるボタンが押せません。画面の体裁も少しおかしいようです。どうしたらよいですか?
回答:
使用されているブラウザがサポート対象外のものですと、動作が不安定になるようです。(画面の表示がずれたり、ボタンが押せない、ファイルがダウンロードできない、などの事例があります)
システムを使用するにあたっては、「サポート対象webブラウザ」 をご確認ください。
また、ご使用のパソコンがMacの場合も動作が不安定になるようです。Windowsのパソコンでご利用ください。
実施途中からの試験参加(追加施設)
質問59 :新たにJCOG参加施設となりました。臨床研究法に従う試験に参加予定です。手続きについておしえてください。
回答:
臨床研究法に従う試験では、施設追加についてCRBに変更申請して承認を得る必要があります。CRBの変更申請の時期は試験毎に異なりますので(1年に2回が目安)、研究事務局からの案内メールをお待ちください。
質問60 :新規申請の際、書類提出が期限に間に合いませんでした。試験に参加したいですが、どうしたらよいですか?
回答:
新規申請が完了した後に行う変更申請の際に、追加で申請していただけます。変更手続きは試験ごとに時期を決めて定期的に行っていますので、研究事務局からの変更申請の案内メールをお待ちください。
参加取り下げ
質問61 :当院は「JCOG協力施設」となり、当該試験で患者登録はありません。研究事務局から変更申請の案内メールが届きましたが、CRB変更申請の書類提出は必要でしょうか
回答:
変更申請の案内メールに、ご施設が取り下げする施設として記載されている場合、今回のCRB変更申請で貴院の参加取り下げを申請しますので、書類の作成は不要です。CRBで参加取り下げが承認されましたら、研究事務局を通じてご連絡しますので、管理者への報告を進めてください。
質問62 :当院は「JCOG協力施設」となり、当該試験で患者登録があります。研究事務局から変更申請の案内メールが届きましたが、CRB変更申請の書類提出は必要でしょうか。
回答:
JCOG協力施設となった後も、患者登録がある試験では試験が終了するまでご参加いただきます。
今回、変更する事項がある場合はCRB変更申請の提出書類をご提出ください。
その他の手引き
